島津賞 ~Shimadzu Prize~
最新の受賞者情報
2025年度島津賞

東京大学 定量生命科学研究所 教授
胡桃坂 仁志 氏(58才)
受賞者には、表彰状・賞牌・
副賞500万円を贈呈
副賞500万円を贈呈
- 研究業績
- クロマチン複合体構造の革新的解析法とエピゲノム動作原理の解明
- 推薦学会
- 日本分子生物学会
- 受賞理由
-
真核生物のゲノムDNAは、ヌクレオソームを基本単位とするクロマチンとして細胞核内に収納されている。クロマチン構造は多様なエピゲノム因子の複合的な作用によって動的に変化し、遺伝子の発現を制御する。クロマチン構造の異常はさまざまな疾患と関連しており、エピゲノム因子によるクロマチンの動作原理の解明は、基礎生命科学や創薬研究において極めて重要である。胡桃坂氏は、エピゲノム情報を含むクロマチン複合体を試験管内で再構成する独自の技術を確立し、世界的に高水準な技術へと発展させた。この技術を基に、クロマチン上で生じる核内現象を試験管内で再現し、クライオ電子顕微鏡などの構造解析手法を組み合わせることで、遺伝子機能を制御する重要なクロマチン複合体の立体構造を次々と明らかにした。さらに、クロマチン複合体を細胞から直接精製して可視化する革新的なChIP-CryoEM法を確立し、生命現象の根幹を担うクロマチン構造の変動メカニズムを解明している。以上のように、胡桃坂氏はクロマチン構造と機能の研究において卓越した成果を挙げており、その独創的かつ先駆的な研究業績を高く評価し、島津賞受賞者として選定した。
胡桃坂氏の島津賞受賞については、下記HPでも紹介されています。
東京大学HP/定量生命科学研究所HP - 研究内容
-
ヒトを含む真核生物注1では、ゲノムDNAがヒストンと呼ばれるタンパク質に巻き付いて「ヌクレオソーム」を形成し、これが連なって折りたたまれクロマチンを構成しています。さらにクロマチンは、様々な調節因子が結合し高次に折りたたまれることで細胞核内に収納されていますが、ヒストン翻訳後修飾注2やヒストンバリアント注3、様々な結合因子など、エピゲノム因子注4によって動的に機能・形態を調節され、遺伝子の発現注5や修復、複製といった生命活動をエピジェネティック注4に制御しています。近年、こうしたクロマチン調節機構の破綻が、がんや老化、発生異常などの原因となることも明らかになり、クロマチン構造の理解は基礎生物学から医学・創薬まで幅広く重要な課題です。
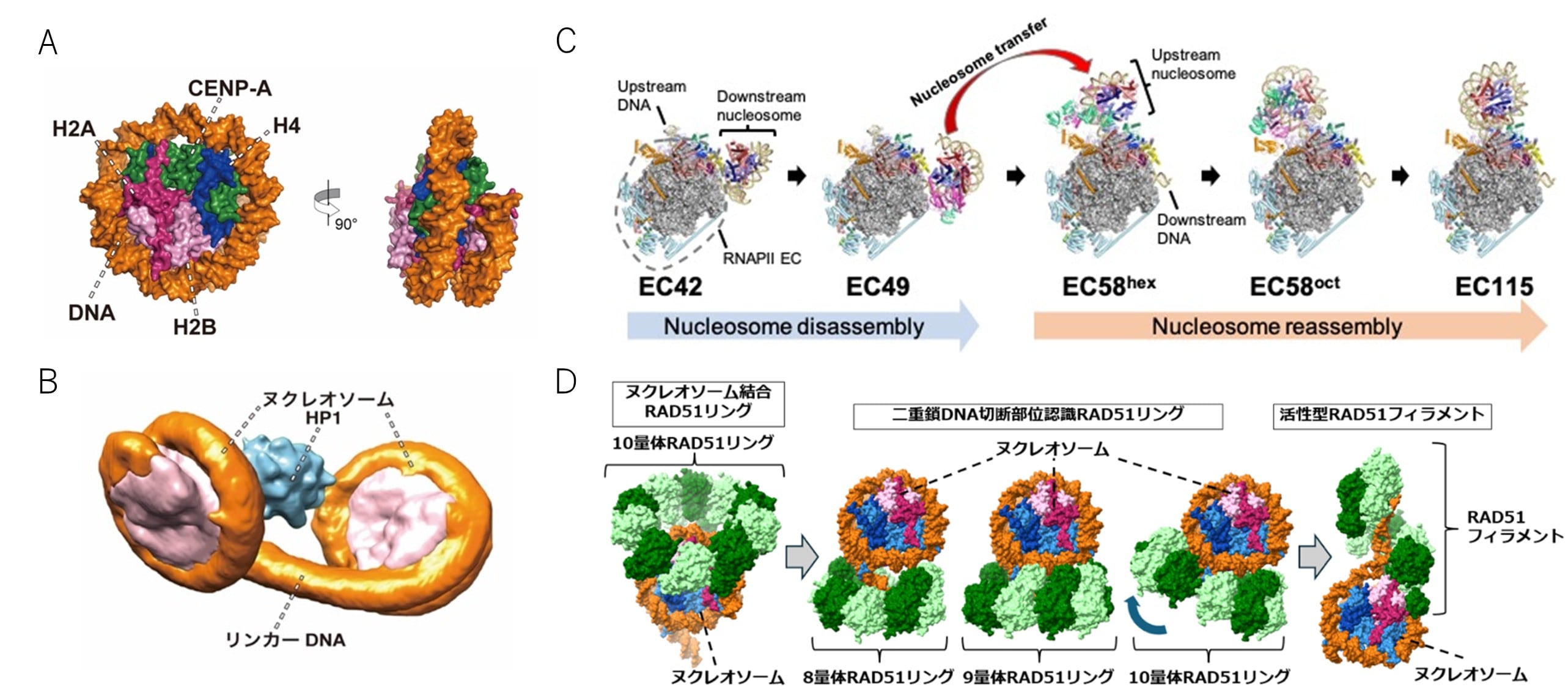
胡桃坂仁志氏は、試験管内でヒストン翻訳後修飾他のエピゲノム因子を自在に組み込んだクロマチン複合体を再構成し、その立体構造と機能を原子レベルで解明する独自の研究基盤を確立しました。これにより、例えば、染色体分配注6に必須なセントロメア注7を特徴付けるヒストンバリアントCENP-Aを含むヌクレオソーム(図1A)や、遺伝子が不活性化されたヘテロクロマチンの基盤構(図1B)、発がんやDNA修復に関わる多様なクロマチン結合因子の結合様式など、エピゲノム因子を含むクロマチン複合体の立体構造とその動作原理をクライオ電子顕微鏡(cryo-EM)法注8やX線結晶構造解析によって次々と明らかにしてきました。さらに、RNAポリメラーゼII注9によるクロマチン上での転写注10(図1C)や、DNA修復タンパク質RAD51による相同組換え注11修復の開始(図1D)など、クロマチン上で実際に起こる生命現象を試験管内で再現し、それらの構造・機能を詳細に解析することにも成功しています。これらの成果は、世界的な生物学の教科書「Molecular Biology of the Cell(細胞の分子生物学)」第7版にも掲載されるなど、国際的にも高く評価されています。
加えて胡桃坂氏は、クロマチン免疫沈降法(ChIP)注12とクライオ電子顕微鏡(cryo-EM)法、質量分析法を組み合わせた革新的な「ChIP-CryoEM法」を開発しました。この手法により、細胞核から直接抽出した転写中のRNAポリメラーゼII複合体の立体構造を、細胞内の状態に近い形で可視化することに世界で初めて成功しています(図2)。この技術は、細胞内クロマチン複合体の構造と機能の統合的理解を大きく進展させるものとして、今後の生命科学・医学研究に新たな地平を拓くと期待されています。 - 用語解説
- 注1 真核生物
膜で囲まれた細胞核を持つ生物の総称であり、動物、植物、菌類、原生生物などが含まれる。 - 注2 ヒストン翻訳後修飾
ヒストンタンパク質におけるアセチル化、メチル化、リン酸化などの化学修飾。これらの修飾はクロマチン構造やヌクレオソーム結合因子の状態を変化させ、遺伝子発現を制御する。 - 注3 ヒストンバリアント
標準的なヒストンとは異なるアミノ酸配列を持つ特殊なヒストン。クロマチン構造や機能の多様性に寄与。 - 注4 エピジェネティック・エピゲノム因子
DNA配列を変えずに化学修飾、タンパク質、RNAなどの作用で遺伝子の働きを調節する仕組み。細胞分化などを精密に制御する。エピゲノム因子は、これらの変化を引き起こすタンパク質・酵素、RNAなどの総称。 - 注5 遺伝子の発現
DNAに記された遺伝情報が、転写により合成されたRNAをもとに、タンパク質が合成される一連の過程。 - 注6 染色体分配
細胞分裂時に染色体が正しく2つの細胞に分配されること。複製された染色体が細胞中央に並び、紡錘体と呼ばれる分裂装置によって両極へ正確に引き分けられることで行われる。 - 注7 セントロメア
染色体の中央付近に位置し、細胞分裂時に染色体が正しく分配されるための足場となる領域。セントロメア領域に、特異的に存在するヒストンCENP-Aがあることで、染色体分配の目印・足場となる。 - 注8 クライオ電子顕微鏡法
生体分子を凍結し、電子顕微鏡で高分解能観察する分子構造の解析技術。試料を急速凍結して観察することで、溶液中に近い状態で生体分子の原子レベルの構造を解析することができる。 - 注9 RNAポリメラーゼ/RNAポリメラーゼII
DNAからRNAを合成する酵素。RNAポリメラーゼIIはタンパク質をコードする遺伝子の転写を担う主要な酵素。RNAはDNAの遺伝情報を基に作られ、タンパク質合成の設計図となり、細胞の働きを調節する。 - 注10 転写
DNAに記された遺伝情報が、RNAに写し取られること。 - 注11 相同組換え
DNAの二本鎖切断を、相同な配列のDNAを鋳型として正確に修復する仕組み。ゲノムの安定維持に必須。 - 注12 クロマチン免疫沈降法(ChIP)
細胞内の特定タンパク質とDNAとの複合体を抗体で精製し、ゲノム上の結合位置や複合体構成成分などを解析する手法。
- 受賞業績の概念図
-
図1 クロマチン試験管内再構成技術を基盤としたエピゲノム因子を含むクロマチン複合体の構造解析成果
- (A)セントロメアの基盤構造を形成するCENP-Aを含むヌクレオソームの立体構造
- (B)HP1タンパク質が結合したヘテロクロマチンの基盤構造
- (C)RNAポリメラーゼII伸長複合体がヌクレオソームを解体・再生する過程
- (D)DNA修復タンパク質RAD51がクロマチン上で修復を開始するメカニズム
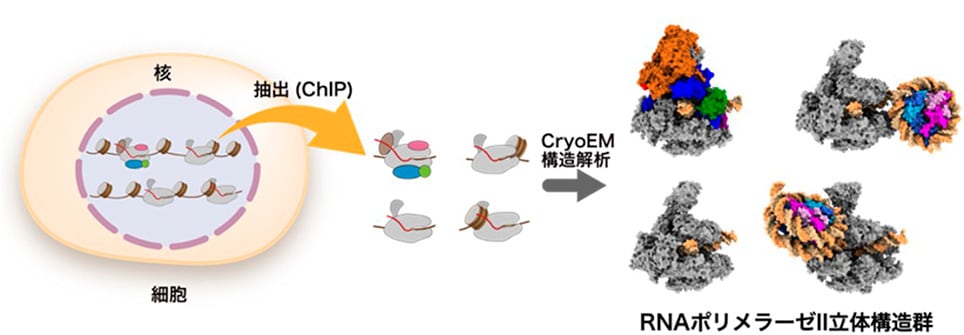
-
図2 ChIP-CryoEM法による細胞由来RNAポリメラーゼII複合体の立体構造解析の成果
- 島津賞(2025年度)受賞者<胡桃坂仁志氏>のプロフィール
- 主な略歴
-
1989年 3月 東京薬科大学薬学部衛生薬学科 卒業(薬剤師免許取得) 1991年 3月 東京薬科大学大学院薬学研究科 博士前期課程修了 薬学修士 1995年 3月 埼玉大学大学院理工学研究科 博士後期課程修了 博士(学術) 1995年 4月 理化学研究所 奨励研究員 1995年 6月 National Institutes of Health(アメリカ合衆国)博士研究員 1997年 6月 理化学研究所 研究員 2003年 4月 早稲田大学理工学部 助教授(2007年4月より准教授) 2008年 4月 早稲田大学先進理工学部 教授(2018年3月まで) 2008年 4月(〜2022.3) 横浜市立大学 客員教授 2013年 4月(~2017.3) 基礎生物学研究所 運営委員 2016年 4月(〜2016.9) 京都大学 客員教授 2018年 4月(〜現在) 早稲田大学 名誉教授 2018年 4月(〜現在) 理化学研究所 客員主管研究員 2018年 4月 東京大学 定量生命科学研究所 教授(現職) 2020年 2月(〜現在) 東京薬科大学 客員教授
- 主な受賞歴
-
2018年 柿内三郎記念賞 (公社)日本生化学会、(公財)倶進会
「ゲノム機能を制御するエピジェネティクスの構造・生化学基盤」2020年 持田記念学術賞 (公財)持田記念医学薬学振興財団
「エピゲノム創薬のクロマチン構造基盤の構築」2021年 文部科学大臣表彰科学技術賞 文部科学省
「ゲノムDNA機能を制御するクロマチン構造基盤の研究」2023年 2022年度 上原賞 (公財)上原記念生命科学財団
「ゲノム機能発現におけるクロマチンの構造基盤の解明」2025年 令和6年度 第65回 東レ科学技術賞 (公財)東レ科学振興会
「ゲノム機能制御におけるクロマチン構造と機能の解明」
島津賞とは
島津賞は、科学技術、主として科学計測に係る領域で、基礎的研究および応用・実用化研究において著しい成果をあげた功労者を表彰します。表彰は毎年原則1名で、表彰者には賞状、賞牌、および副賞500万円を贈呈します。
- 歴代の島津賞受賞者はこちら → 島津賞受賞者一覧




