掲載されている内容はすべて発表日当時のものです。その後予告なしに変更されることがありますのであらかじめご了承ください。
2025年12月15日 | プレスリリース 2025年度島津賞・島津奨励賞受賞者決定 -研究開発助成は23件を選定-
公益財団法人 島津科学技術振興財団(理事長 榊 裕之)は12月5日に開催した当財団理事会において、2025年度 島津賞受賞者1名、島津奨励賞受賞者3名、および研究開発助成金受領者(領域全般20名、新分野3名)を決定しましたのでお知らせいたします。
当財団は、科学技術に関する研究開発の助成および振興を図る目的で1980年に島津製作所の拠出資金により設立され、2012年4月に公益財団法人に移行しました。基本財産は約30億円です。
島津賞は、『科学技術、主として科学計測に係る領域で、基礎的研究および応用・実用化研究において、著しい成果をあげた功労者』を表彰するものです。島津奨励賞は2018年度に創設された顕彰事業であり、『科学技術、主として科学計測に係る領域で、基礎的研究および応用・実用化研究において独創的成果をあげ、かつその研究の発展が期待される45歳以下の研究者』を表彰するものです。
また研究開発助成は、『主として科学計測に係る科学技術領域と新分野で、独創的研究を対象とし、国内の研究機関に所属する45歳以下の研究者』を助成するもので、 当財団では、“主として科学計測に係る科学技術領域”を【領域全般】と称しています。また【新分野】は、財団が毎年テーマを指定しており、今年度は『先進情報技術の研究分野、または先進情報技術やデータサイエンスを用いて科学的課題解決を目指す研究分野』をテーマとして募集しました。
今年度は、領域全般で20件、新分野で3件の総計23件を選出しました。採択となった研究は、いずれも先端技術に関するもので、今後その成果・発展が期待されます。
1.島津賞
当財団の推薦依頼学会に推薦依頼し、推挙された中から、当財団選考委員会および 理事会にて、受賞者1名を選出しました。受賞者には、表彰状・賞牌・副賞500万円を贈呈いたします。
受賞者
東京大学 定量生命科学研究所
教授 胡桃坂 仁志氏

| 受賞業績 | : | クロマチン複合体構造の革新的解析法とエピゲノム動作原理の解明 |
| 推薦学会 | : | 日本分子生物学会 |
| 受賞理由 | : | 真核生物のゲノムDNAは、ヌクレオソームを基本単位とするクロマチンとして細胞核内に収納されている。クロマチン構造は多様なエピゲノム因子の複合的な作用によって動的に変化し、遺伝子の発現を制御する。クロマチン構造の異常はさまざまな疾患と関連しており、エピゲノム因子によるクロマチンの動作原理の解明は、基礎生命科学や創薬研究において極めて重要である。胡桃坂氏は、エピゲノム情報を含むクロマチン複合体を試験管内で再構成する独自の技術を確立し、世界的に高水準な技術へと発展させた。この技術を基に、クロマチン上で生じる核内現象を試験管内で再現し、クライオ電子顕微鏡などの構造解析手法を組み合わせることで、遺伝子機能を制御する重要なクロマチン複合体の立体構造を次々と明らかにした。さらに、クロマチン複合体を細胞から直接精製して可視化する革新的なChIP-CryoEM法を確立し、生命現象の根幹を担うクロマチン構造の変動メカニズムを解明している。以上のように、胡桃坂氏はクロマチン構造と機能の研究において卓越した成果を挙げており、その独創的かつ先駆的な研究業績を高く評価し、島津賞受賞者として選定した。 |
| 研究内容 | : |
ヒトを含む真核生物注1では、ゲノムDNAがヒストンと呼ばれるタンパク質に巻き付いて「ヌクレオソーム」を形成し、これが連なって折りたたまれクロマチンを構成しています。さらにクロマチンは、様々な調節因子が結合し高次に折りたたまれることで細胞核内に収納されていますが、ヒストン翻訳後修飾注2やヒストンバリアント注3、様々な結合因子など、エピゲノム因子注4によって動的に機能・形態を調節され、遺伝子の発現注5や修復、複製といった生命活動をエピジェネティック注4に制御しています。近年、こうしたクロマチン調節機構の破綻が、がんや老化、発生異常などの原因となることも明らかになり、クロマチン構造の理解は基礎生物学から医学・創薬まで幅広く重要な課題です。 |
| 用語解説 | : |
注1 真核生物 注2 ヒストン翻訳後修飾 注3 ヒストンバリアント 注4 エピジェネティック・エピゲノム因子 注5 遺伝子の発現 注6 染色体分配 注7 セントロメア 注8 クライオ電子顕微鏡法 注9 RNAポリメラーゼ/RNAポリメラーゼII 注10 転写 注11 相同組換え 注12 クロマチン免疫沈降法(ChIP) |
受賞業績の概念図
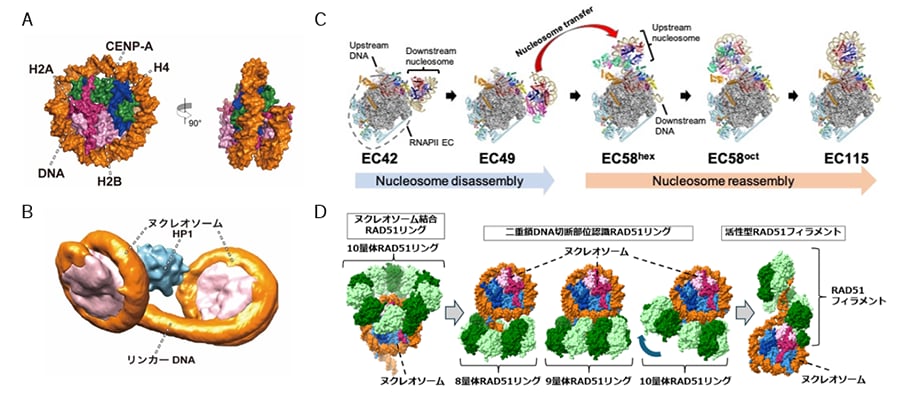
図1 クロマチン試験管内再構成技術を基盤としたエピゲノム因子を含むクロマチン複合体の構造解析成果
(A)セントロメアの基盤構造を形成するCENP-Aを含むヌクレオソームの立体構造
(B)HP1タンパク質が結合したヘテロクロマチンの基盤構造
(C)RNAポリメラーゼII伸長複合体がヌクレオソームを解体・再生する過程
(D)DNA修復タンパク質RAD51がクロマチン上で修復を開始するメカニズム
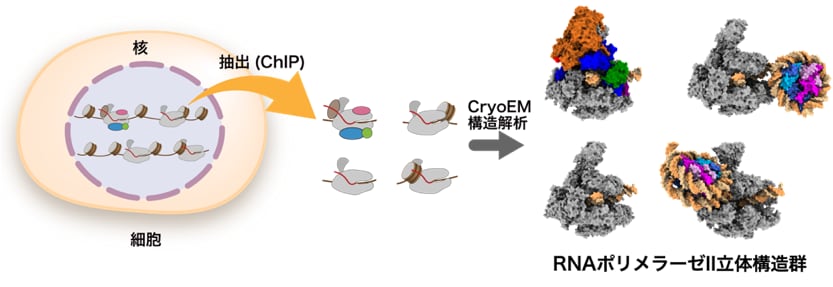
図2 ChIP-CryoEM法による細胞由来RNAポリメラーゼII複合体の立体構造解析の成果
2.島津奨励賞
当財団の推薦依頼学会および当財団関係者に推薦依頼し、推挙された中から、当財団選考委員会および理事会にて、受賞者3名を選出しました。受賞者には、表彰状・トロフィー・副賞100万円を贈呈いたします。
受賞者
東京大学 大学院医学系研究科
教授 岡田 随象氏

| 受賞業績 | : | 遺伝統計学による疾患病態解明・個別化医療・ゲノム創薬の基盤形成 |
| 推薦者 | : | 日本生化学会 |
| 受賞理由 | : | 多層的オミクス計測情報を統合し、病態解明や創薬、個別化医療へとつなげる学術基盤形成が急務である。岡田氏は遺伝統計学を専門とし、ヒト疾患感受性遺伝子基盤の形成と、ゲノム個別化医療やゲノム創薬研究に貢献した。機械学習のヒトオミクス情報への実装手法開発にも先駆的に取り組み、疾患病態に関わる細胞組織の特定を果たした。縄文人ゲノムの現代日本人への影響、機械学習を用いた白血球血液型の推定、X染色体不活化逃避の一細胞解像度の定量化、日本人集団腸内細菌叢の疾患発症への寄与、COVID-19重症化機構の関与、ウイルス感染が引き金となる自己免疫疾患の発症、加齢に伴う異常造血であるクローン性造血における免疫プロファイルの一細胞解像度の解明など、生命医科学における数々の謎を解き明かすなどの研究成果に加え、「遺伝統計学・夏の学校」を自主開催するなど、遺伝統計学・オミクス解析の若手人材育成への寄与なども評価し、島津奨励賞受賞者として選定した。 |
受賞者
東京大学 大学院理学系研究科
准教授 井手口 拓郎氏

| 受賞業績 | : | 超解像赤外顕微鏡の開発 |
| 推薦者 | : | 応用物理学会 |
| 受賞理由 | : | 赤外吸収分光は、分子の振動を高感度に検出できるため、ラベルフリーで化学組成を可視化するケミカルイメージングとして有用である。しかし、光の波長が長いため、従来の赤外顕微鏡では空間分解能が細胞サイズに制限され、生体計測への応用が困難であった。井手口氏は、この課題を克服するため、中赤外光の吸収による微小な温度上昇が屈折率変化を引き起こす点に着目し、その屈折率変化を可視光で高感度に検出する「中赤外フォトサーマル顕微鏡」を開発した。この手法は、赤外吸収の化学選択性と可視光の高空間分解能を融合し、空間分解能120 nmの超解像およびビデオレートを超える高速撮像を実現した。これにより、細胞や細菌の分子振動イメージングを高精細に取得し、細胞内の熱拡散や熱泳動などの熱物理現象を直接可視化する新たな生物物理学的ツールへと発展させた。 これらの業績は、生命科学研究と医療応用に大きな波及効果が期待される革新的技術であると評価し、島津奨励賞受賞者として選定した。 |
受賞者
東京大学 物性研究所
准教授 松永 隆佑氏

| 受賞業績 | : | 高速テラヘルツ分光による超伝導体及びトポロジカル物質の基礎特性解明と機能開拓 |
| 推薦者 | : | 過年度島津賞受賞者 |
| 受賞理由 | : | テラヘルツ波は、周波数が可視光よりも約3桁低く、通信で用いられる電波と比べると約3桁高い、光と電波の中間に位置する特殊な電磁波である。テラヘルツ帯では固体に内在する様々な自由度に由来する多彩な電磁応答が現れるため、テラヘルツ帯で固体の基礎特性を解明し、新規機能性を開拓することが強く望まれている。松永氏はテラヘルツパルスを使った超高速時間分解計測技術を駆使して、超伝導体やトポロジカル物質において発現する物理現象の解明において多くの業績を挙げてきた。特筆すべき成果として、素粒子物理と超伝導の類似性に着目して超伝導秩序変数の振動モード(ヒッグスモード)の観測に成功したほか、質量ゼロのディラック電子が示す室温高効率テラヘルツ高次高調波発生の発見、ワイル反強磁性体が示す巨大異常ホール効果のテラヘルツ高速計測などが挙げられる。これらはいずれも、固体中で巨視的に発現する量子力学的現象を光技術の立場から解明した先駆的成果である。光物性物理学の新たな潮流を生み出し、今後も更なる発展への寄与が期待されることを評価した。 |
3.研究開発助成(23件)
応募のあった中から、当財団選考委員会および理事会にて研究開発助成金受領者を下記の通り選出しました。1件あたり100万円の研究開発助成金を授与いたします。科学計測に係わる領域を広く対象をしてとらえた「領域全般」への応募から20件を選定し、加えて、当財団が設定した科学計測に係わる領域で、今後重要となると考えられる新規な分野を対象として助成する「新分野」(今年度のテーマは、『先進情報技術の研究分野、または先進情報技術やデータサイエンスを用いて科学的課題解決を目指す研究分野』)への応募から3件を、それぞれ選定しました。採択となった研究は、いずれも先端技術に関するもので、今後その成果・発展が期待されます。
領域全般 20件(助成総額2,000万円)
|
研究者(五十音順)
|
研究題目
|
助成金額
|
|
|---|---|---|---|
| 1 | 東北大学 国際放射光イノベーション・ スマート研究センター 助教 阿部 真樹 |
コヒーレントX線を用いた高速化学状態ナノイメージング法の開発 | 100万円 |
| 2 | 名古屋大学 医学部附属病院 脳神経外科 病院助教 石﨑 友崇 |
ヒト脳内電極脳波によるてんかんネットワークの解明と患者仮想脳の構築 | 100万円 |
| 3 | 大阪公立大学 大学院情報学研究科 基幹情報学専攻 准教授 内海 ゆづ子 |
CT計測と画像認識に基づく花序形成プロセスの数理モデル構築 | 100万円 |
| 4 | 名古屋大学 大学院工学研究科 機械システム工学専攻 助教 大家 広平 |
流動逆解析に基づく複雑流体レオロジー計測技術の開発 | 100万円 |
| 5 | 広島大学 大学院医系科学研究科 生理学及び生物物理学 特別研究員PD 大西 康平 |
新規温度センサー分子を指標とした神経温度応答解析 | 100万円 |
| 6 | 東京科学大学 生命理工学院 特任准教授 小坂田 拓哉 |
神経ペプチドセンサーの脳内多点in vivo記録法の開発 | 100万円 |
| 7 | 大阪大学 レーザー科学研究所 光量子ビーム科学研究部門 特任助教(常勤) 加藤 康作 |
励起波長可変テラヘルツ放射分光によるSPR誘起電荷移動の計測 |
100万円 |
| 8 | 産業技術総合研究所 物理計測標準研究部門 高周波標準研究グループ 主任研究員 岸川 諒子 |
AI向け超高速3次元集積回路のための高周波非線形測定技術 | 100万円 |
| 9 | 九州大学 大学院工学研究院 機械工学部門 助教 草野 和也 |
複雑流動場の音響リモートセンシングを実現する逆解析手法の構築 | 100万円 |
| 10 | 千葉大学 大学院薬学研究院 講師 鈴木 博元 |
放射性ペプチド医薬品の新規精製法の開発 | 100万円 |
| 11 | 九州大学 高等研究院・生体防御医学研究所 脳機能分子システム分野 准教授 髙野 哲也 |
精神疾患の回路病態に迫る次世代プロテオーム計測プラットフォームの構築 | 100万円 |
| 12 | 大阪大学 大学院工学研究科 電気電子情報通信工学専攻 助教 高橋 秀実 |
高時間分解能・偏光ラマン分光法によるレーザー濃縮の探求 | 100万円 |
| 13 | 東京都立大学 理学部 物理学科 助教 谷口 大輔 |
超高速度星をプローブとした天の川銀河中心のr過程元素組成測定法 | 100万円 |
| 14 | 新潟大学 医学部医学科研究推進センター 助教 中谷 航太 |
親水性メタボロームとリピドームの同時分析法の開発 | 100万円 |
| 15 | 北海道大学 大学院医学研究院 クリニカルシミュレーションセンター 助教 パウデル サシーム |
AI科学計測による腹腔鏡・ロボ鼠径ヘルニア手術技能評価 | 100万円 |
| 16 | 名古屋大学 医学部附属病院 循環器内科 病院助教 平岩 宏章 |
X線動態解析による低侵襲的心機能計測および新規診断支援技術の開発 | 100万円 |
| 17 | 慶應義塾大学 理工学部 応用化学科 准教授 蛭田 勇樹 |
長時間生体イメージングを可能にするケージドルシフェリンの開発 | 100万円 |
| 18 | 芝浦工業大学 工学部 電気電子工学課程 先端電子工学コース 准教授 深田 健太 |
広帯域誘電分光法による細胞代謝の非侵襲計測 | 100万円 |
| 19 | 名古屋大学 医学部附属病院 脳神経外科 助教 村岡 真輔 |
くも膜下出血の周術期管理に関する個別化医療モデルの開発 | 100万円 |
| 20 | 神戸大学 大学院システム情報学研究科 システム計測専攻 准教授 米田 成 |
高輝度量子もつれ光源を用いた二光子吸収顕微鏡の開発 | 100万円 |
新分野 3件(助成総額300万円)
【今年度の募集テーマ】『先進情報技術の研究分野、または先進情報技術やデータサイエンスを用いて科学的課題解決を目指す研究分野』
|
研究者(五十音順)
|
研究題目
|
助成金額
|
|
|---|---|---|---|
| 1 | 岐阜大学 高等研究院・大学院医学系研究科 特任助教 岡田 大瑚 |
細胞若返りの新指標と薬剤カクテル最適化 | 100万円 |
| 2 | 東海大学 医学部・総合診療学系 総合内科学 講師 後藤 信一 |
人工知能による新規呼気ガス計測技術を活用した肝疾患の検出 | 100万円 |
| 3 | 愛媛大学 大学院理工学研究科 理工学専攻 機能材料工学講座 准教授 城塚 達也 |
機械学習による昇温脱離解析手法の開発 | 100万円 |
表彰式・研究開発助成金贈呈式、並びに受賞記念講演は、次の通り行います。
| 日 時 | : | 2026年2月17日(火) | |
| 次 第 | : | 表彰・贈呈式 | 13:30~14:30 |
| 島津賞、島津奨励賞受賞記念講演 | 14:40~16:10 | ||
| 場 所 | : | ホテルオークラ京都(京都市中京区河原町御池) | |


