Backnumber
Backnumber
(注)所属・役職および研究・開発、装置などは取材当時のものです。
加速する生命科学研究
ヒトゲノムの新常識
独立行政法人理化学研究所 ゲノム科学総合研究センター長 理学博士 榊 佳之
2003年4月、ヒトゲノムの解読終了が宣言された。
生命の設計図とされるDNAの全塩基配列が読み取られ、科学者のみならず、世界中が、生命の秘密に大きく近づいたと色めき立った。
だが、理化学研究所ゲノム科学総合研究センター長の榊佳之氏は、ゲノム研究の現状を、「ようやく二つ目のステップに入ったところ」という。
ゲノム研究は今どんな問題と直面しているのか。
また、生命の秘密が解き明かされるまであと何が必要なのか、榊氏に伺った。
ヒトゲノムを「解く」
「ヒトゲノム計画の成果は基本設計図を手にしたという点で非常に大事でした。でも、それはゲノム研究の全容からいえば、“とっかかり”ができたというだけ。ここからがなかなか大変なんです」
ゲノム研究の世界の第一人者として知られる榊氏は、明快に語る。
榊氏は1960年代から、日本のゲノム研究の中核で活躍してきた。ヒトゲノム計画では日本チームのとりまとめ役を任され、ヒトゲノム国際組織HUGOの会長も務めた。
いま理化学研究所ゲノム科学総合研究センターを中心に、ゲノムネットワーク計画という新たなプロジェクトが進行しつつある。これが榊氏のいう次のステップで、ゲノムに含まれている多彩な「役者」がどういう関係にあるかを解明しようとするものだ。

「ゲノム」線の「遺伝子」駅
ゲノムの本体であるDNAは梯子をねじったような構造をしている。この梯子の横木にあたる部分はアデニン(A)、チミン(T)、シトシン(C)、グアニン(G)という4種類の塩基が、A-T、C-Gという組み合わせで結合しており(塩基対という)、これは、大腸菌もハエもマウスもヒトも変わることはない。
人間の場合、30億の塩基対があり、その全長は1.5メートルに及ぶ。ヒトゲノム計画では、すべての塩基の並び順が解き明かされ、そこに記録されている「遺伝子」の数は2万~3万と推測された。
「ゲノム」と「遺伝子」の関係は、「砂漠と都市」「線路と駅」などと例えられることが多い。それは、長大なゲノムのなかで遺伝子に該当する部分がほんの少ししかなく、ぽつんぽつんと散らばっているからだ。
ここでいう遺伝子とは、タンパク質のアミノ酸配列情報を記したDNA部分を指す。我々の身体はタンパク質を基本としてできていることから、生命機能を担うのはタンパク質で、それをつくる情報が記録されている部分こそ「遺伝子」であるという考えが科学界でも支配的だった。
実際、この定義でDNAを見渡してみると、遺伝子はゲノムのわずか2~3%程度に過ぎない。では、それ以外の98%のゲノム情報はいったい何をしているのか。「何もしていない」という見方が定説だった。「ジャンク(ごみ)DNA」とも呼ばれ、研究の対象となることも稀だった。
だが、近年、それだけでは到底理解できない事象が次々と明らかになってきた。「タンパク質に翻訳はされないものの、RNAに転写されるDNA部分がものすごく多いということがわかってきました。そしてそういうRNAが、発生や体の機能を正常に保つうえで、非常に重要な役割を果たしていることもわかってきたんです」
ジャンクDNAに存在したRNA新大陸
最初の発見は線虫だった。
線虫は、その発生の全段階を顕微鏡下で追える非常にユニークな生物だ。その発生に異常を起こす物質として小さなRNAが見つかった。
「本当に小さな、数十塩基がつながっただけのマイクロRNAなんです。でも、これがないだけで、線虫は生まれてくることができない」
ヒトでも興味深い事実が見つかった。ヒトの女性にはX染色体が二つあるが、二つのうち一つは遺伝子が発現しないよう不活化されている。この現象そのものは、古くから知られていたが、なぜ片方だけ働いて、片方が働かないかは謎だった。だがこれも特殊なRNAが引き金となり、働かないよう固定しているということが明らかになった。
同センターには、RNA研究で精力的に活動している林崎良英氏のグループがある。その報告によれば、実際のところ、全ゲノムの70%がなんらかの形で読まれているという。この内容を論文にまとめて2005年9月に発表したところ、国際的に高いインパクトを与えた『RNA大陸の発見』とも言われている。「どうやら、タンパク質をコードしている遺伝子よりも、もっと多い数の『ノンコーディングRNA』が存在していて、それぞれ結構大事な役割を果たしているらしい。でも、それぞれが何をやっているかというと、こう推測されるという仮説が多くて、はっきりとは分からない。これからしっかり立証していかなくてはならないでしょうね」
たとえばアンチセンスRNAと呼ばれるRNAがある。ある遺伝子が読まれるとき、DNAの二重鎖のちょうど反対側のDNA(相補的DNAといわれる)も同時に読まれて、RNAとなって細胞質に出ていく(図1参照)。これが遺伝子から転写されたメッセンジャーRNAに結合すると特殊な仕組みでメッセンジャーRNAは分解されてしまします。これを人為的に起こして、特定の遺伝子の機能を阻害する技術(RNA干渉)も開発され、大いに研究の進展に寄与している。
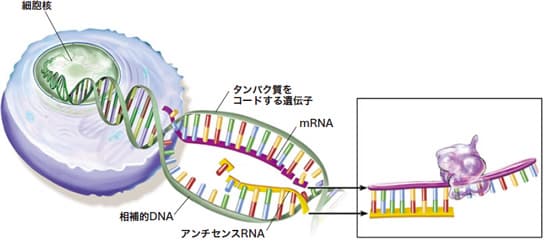
図1 出典「日経サイエンス(別冊146)」
アンチセンスRNAの働き
DNAの二重らせん上で、タンパク質をコードする遺伝子部分のちょうど反対側に位置する塩基配列を相補的DNAと呼ぶ。遺伝子部分のDNAとは写真のネガとポジの関係にあたるまったく逆の塩基配列からなっている。これを転写したRNAがアンチセンスRNAで、遺伝子部分を転写したmRNAとはやはりネガとポジの関係となる。そして、mRNAがリボソームでタンパク質を合成しようとする前に、アンチセンスRNAはmRNAに結合してしまい、タンパク質合成を妨害する。
RNAワールドを歩く
こうして見てみると、ゲノムの姿は「線路と駅」というよりも、30億のキーが並んだ鍵盤のようなものといえるかもしれない。すべてのキーは音階を持っていて、正しく制御されたら美しい和音を奏でる。
そもそも太古の昔、生命はRNAとして初めてこの世に生まれたとされる。だがRNAは非常に不安定な性質のため、次世代に伝えるべき遺伝情報は安定しているDNAに、その機能、すなわち生命活動はタンパク質に担わせる方向に進化してきたという。つまり最初のRNAは、情報を貯蔵すると同時に酵素活性、すなわちタンパク質の機能を持っていたのだ。
これまで我々の体のなかでRNAといえばメッセンジャーRNA、あるいはトランスファーRNA、リボソームRNAなど、細胞活動のなかでサポート的な役割を果たしているものが多いように見えた。だが、実際には、それ以外の機能を持つRNAが多数あって、そのふるまいが発生や分化、健康体を保つために大いに関係していると見てよさそうだ。

ゲノム研究のゴールへ
これらのRNAを含めゲノムDNA情報をもとに生みだされるすべての因子の役割を特定し、その関係図を描くというのがゲノムネットワークプロジェクトなのである。
榊氏は「数年のうちには基本パターンについて関係図を作成できる」と胸を張る。これはヒトゲノム計画に続く大きな一里塚になるはずだ。
「でも、それはまだ基本的な仕組みがわかったというだけに過ぎません。遺伝子のオンオフは、環境因子を受けてダイナミックに変化します。外界の環境はもちろん、生体が作り出すカルシウムや脂質というものまで含めて、それがどのようにネットワークされているかというのを解明するのは、想像もできないくらい複雑で、本当にまとめきれるのか、私にもわかりません」
ことがここまで発展すれば、生体の観察と分析だけではとてもこと足らず、ダイナミックな変化をシミュレーションするような数理統計解析科学が必要になってくる。
「いま、システムバイオロジーという新しい学問が生まれつつあります。まだ初期的な段階ですが、世界中でフレッシュな感性を持った若い人たちが、どんどんこの分野に参入してきており、期待が持てます。かなり先だとは思いますが、いつかは一つの卵から生体へと発生・分化していく様子をすべてシミュレーションできるようになるはずです。それが私たちのひとつのゴールです」と榊氏は夢を広げる。
「いつかはヒトゲノム全体の制限酵素地図を作る」
1982年に榊氏が雑誌上で発表した目標だ。四半世紀を経て我々は、それを可能にする道具を手に入れた。そして、世界中の研究者が同じ目標に向かい情熱を傾けている。

右から島津製作所執行役員 島津光三分析計測副事業部長、榊佳之センター長、島津製作所ライフサイエンス研究所 中村伸主任研究員
近年の分子生物学の発展はDNAシーケンサの発展を抜きにしては語れない。
シーケンサは、DNAの配列を解析し、その最小単位である4種類の塩基A、G、C、Tの並び方として表す。ゲノムを読む上でもっとも基本となる装置といえる。
ヒトゲノム計画では、国際プロジェクトと米ベンチャー企業セレラ社が、競うようにゲノムの解析を進めたが、後発だったセレラ社が追いついてこれたのは、300台ものシーケンサを一度に稼働させ、アメリカ国防省につぐ当時民間ではもっとも巨大な処理能力を持つコンピュータで、一気に処理をしたためとされている。
「近年のシーケンサの多くは、『速くたくさん読む』ことを念頭に置いて開発が進められています。たしかにそれは大切な要素ではありますが、早いかわりに、データが細切れになるという欠点があります。DNAの全体像を見るためには、この細切れのデータをジグソーパズルのようにはめ込んでいく必要があるのですが、あまりに細かすぎてコンピュータに負荷がかかりすぎ、場合によっては、パズルのどこのピースがわからなくなってしまうこともあります。そんなとき欠かせないのがお手本となるDNAで、これは多少時間がかかっても一度に長く解析できる装置が必要です。いまよりもずっとDNAを長く読むことのできるシーケンサが現れたら、それは分子生物学の新たなブレイクスルーとなるかもしれません」(榊佳之氏)

大量処理型 BioMEMS DNA シーケンサDeNOVA(デノヴァ)-5000HT
理化学研究所ゲノム科学総合センターに導入され、2006年グッドデザイン賞も受賞した島津の最新型DNAシーケンサ。800塩基の長鎖解読能力と、1台で40万塩基程度の大きさの新規ゲノムのドラフト解読を1日でこなす能力があり、シーケンス解読の最大仕様は400万塩基以上。 わずか5μLのサンプル量で解読でき、24時間の全自動運転が可能。

独立行政法人理化学研究所 ゲノム科学総合研究センター長
理学博士 東京大学名誉教授
榊 佳之(さかき よしゆき)
1942年愛知県生まれ。1971年東京大学大学院理学系研究科博士課程修了。九州大学教授、東京大学医科学研究所教授、理化学研究所ゲノム科学総合研究センタープロジェクトディレクターなどを経て、2004年4月より現職。02年から05年までヒトゲノム国際組織HUGO会長も務めた。03年紫綬褒章受章。著書に「ヒトゲノム-解読から応用・人間理解へ-」(岩波書店)などがある。
ノロウイルスRNA遺伝子を糞便検体から直接検出する
研究用ノロウイルス遺伝子検出試薬キット
Ampdirect®Technology
激しい嘔吐が続き、発熱を伴うノロウイルスによる食中毒。
この冬大流行したこの病気の対策にひとすじの光明を投げ掛けたのが、島津が発売した研究用ノロウイルス遺伝子検出試薬キットだ。
手のかかるノロウイルスの検出
2006年は感染者数が1000万人を超えたのではとも言われているノロウイルスの被害。激しい嘔吐と下痢、発熱も伴うこともあり、一部の食品で風評被害が発生するなど、列島を暗雲で包み込むことになった。
ノロウイルスが脅威とされる理由のひとつに、感染力が強い、有効な治療法が見つかっていないなどが上げられる。そのため、食中毒が発生した段階で、一度に大勢の人の検査を早急に行い、原因を見つけ出し、適切な処置をして、拡散を防ぐことが重要となる。
ノロウイルスは培養ができないため、検出するには糞便中に存在するウイルスの遺伝子を増幅する必要がある。ここで問題となるのが、糞便中には遺伝子の増幅を阻害する物質が大量に存在することと、ノロウイルスの遺伝子の本体がRNAであるということだ。生体内はもちろん、環境中にも普遍的に存在し、かつ強力な活性を持つ酵素(RNase)でRNAは容易に分解されるため、DNAと比べて大変取扱が難しい。RNAを増幅して検出する方法は従来からあるが、RNA遺伝子を増幅する前段階として、まず糞便サンプルからウイルスを取り出し、そこに含まれるRNAを分解することなく抽出・精製する工程が必要で、非常に時間と手間とコストがかかっていた。

ダイレクトにノロウイルス遺伝子を検出
ノロウイルスが、世間で騒がれるようになるなか、島津は世界初となる糞便から直接ノロウイルス遺伝子を増幅して検出できる研究用試薬「Ampdirect®Technology -ノロウイルス検出試薬キット(G1,G2)」を発売した。
DNAについては、島津は1997年に血液から直接PCR法で増幅できる試薬「アンプダイレクト」を発売しており、すでに多方面で活用されている。今回、新に開発した生体由来のサンプルの処理液と簡便で迅速な遺伝子診断を可能にするこのアンプダイレクト技術をRNAに適応させ、ノロウイルスを糞便から直接検出する試薬の開発に成功したのだ。
この試薬キットの特徴は、従来の検出法では必須だった生体サンプルからのRNAの分離・精製などの煩雑な前処理が省略できることだ。アンプダイレクト技術の導入により、RNAウイルスをまさに” ダイレクト“にサンプル中から検出することが可能となった。
このキットの開発により、アンプダイレクトはDNAとRNAの両方をカバーできることが証明できた。Ampdirect®Technologyの広範な展開への期待が高まっている。
(注)所属・役職および研究・開発、装置などは取材当時のものです。